Neovascularización/Angiogénesis
![]()
PSI para la neovascularización/angiogénesis
La neovascularización es la formación de nuevas redes microvasculares. In vivo, este proceso se realiza principalmente a través de la angiogénesis, es decir, el desarrollo de nuevos vasos a partir de otros ya existentes. La neovascularización/angiogénesis desempeña un papel fundamental en muchos tratamientos y enfermedades; por ello, se estudia en profundidad en numerosos campos, como la ingeniería de tejidos y la medicina regenerativa, la biología vascular y la biología del cáncer. Existen muchos modelos en función de la aplicación: para el desarrollo/la administración de fármacos, la caracterización de enfermedades y el tratamiento con células madre. Se necesitan herramientas que permitan evaluar la formación de nuevos vasos, preferiblemente mediante métodos no invasivos y no destructivos. El sistema de imágenes de contraste de moteado láser PeriCam PSI puede utilizarse para realizar un seguimiento de los cambios en la perfusión sanguínea microvascular a lo largo del tiempo. Los estudios han demostrado que los incrementos en la perfusión se corresponden con la formación de más vasos sanguíneos funcionales. PeriCam PSI se ha utilizado para elaborar varios de estos modelos.
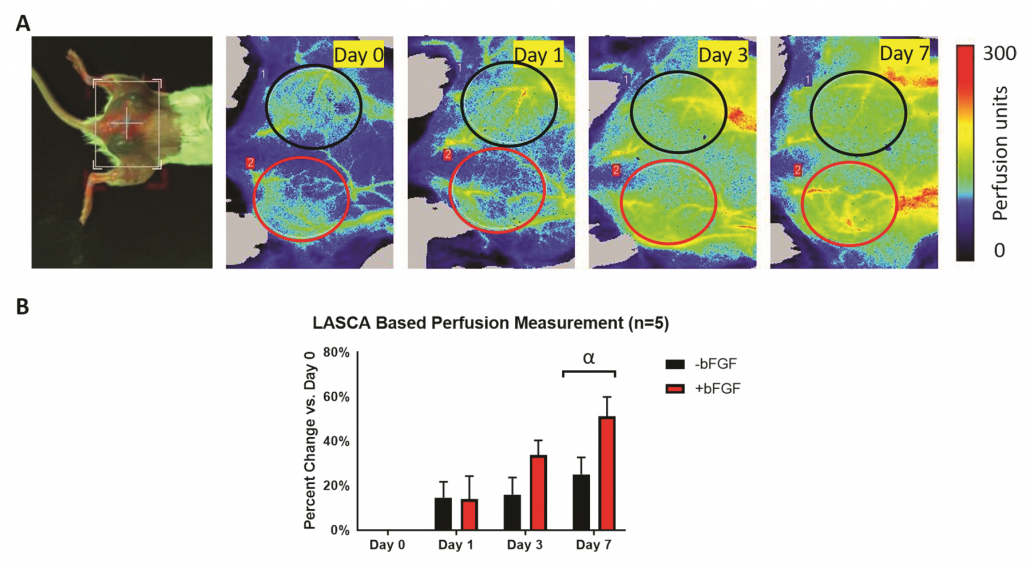
(A) Fotografía de una vista dorsal e imágenes de perfusión longitudinales con PSI de un ratón con dos implantes de andamiajes de fibrina subcutáneos con y sin factor de crecimiento angiogénico. Las ROI se eligieron en función de la ubicación física de los implantes. (B) La cuantificación del cambio en la perfusión con respecto al día 0, según un análisis de las ROI de las imágenes de perfusión con PSI, muestra un aumento global de la perfusión a lo largo del tiempo. El mayor cambio en la perfusión se observó el día 7, en el que los andamiajes +bFGF tienden a mostrar una mayor perfusión que los andamiajes -bFGF 1-2.
Figura por cortesía del Dr. Mario Fabiilli de LED-Based Photoacoustic Imaging for Monitoring Angiogenesis in Fibrin Scaffolds Autores: Yunhao Zhu, Xiaofang Lu, Xiaoxiao Dong, et al. Publicación: Tissue Engineering Parte C: Métodos
Editor: Mary Ann Liebert, Inc. Fecha: 1 de septiembre de 2019.
Aspectos generales
PeriCam PSI ha demostrado ser una herramienta útil en diversos campos dentro del sector de la investigación de la neovascularización y la angiogénesis. Uno de los campos principales es el estudio de los tratamientos proangiogénicos para la arteriopatía periférica y la cicatrización de heridas en modelos con animales preclínicos. En el caso de la APP, la isquemia se provoca quirúrgicamente en la extremidad inferior y se confirma con PeriCam PSI; además, se puede realizar un seguimiento a lo largo del tiempo del proceso dinámico de recuperación de la perfusión. Asimismo, se crean heridas cutáneas y se utiliza PeriCam PSI para comprobar que la cicatrización es normal. En ambos modelos, PeriCam PSI permite al investigador realizar un seguimiento longitudinal de los mismos sujetos, ahorrando tiempo y dinero al reducir el número de animales necesario para el estudio.
Otro campo es el estudio del cáncer en los modelos de tumores subcutáneos y ensayo de la MCA, así como el desarrollo de fármacos antiangiogénicos para el tratamiento. PeriCam PSI puede utilizarse para supervisar la perfusión en los tumores a medida que estos evolucionan, y para evaluar la eficacia de los tratamientos que tienen como objetivo acabar con ellos por inanición.
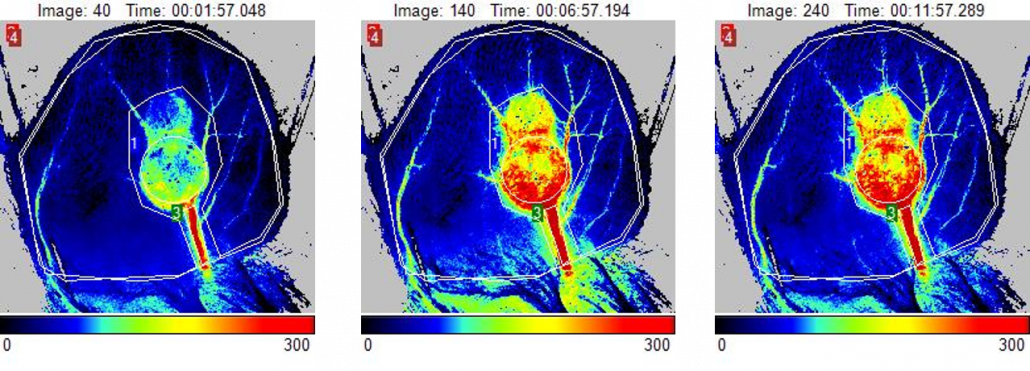
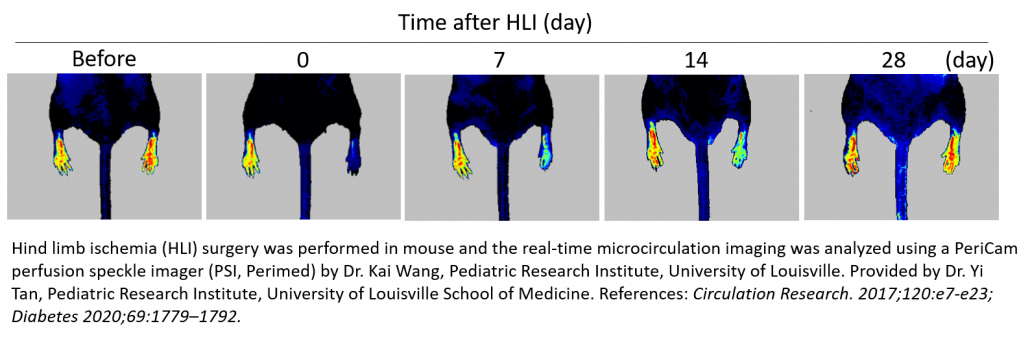
Isquemia en las patas traseras (HLI)
La preparación de isquemia en las patas traseras de ratones es un modelo que se utiliza habitualmente y resulta importante para el estudio de la arteriopatía periférica. En él se procede a la ligadura y la extirpación unilaterales de la arteria femoral para provocar una isquemia aguda en las extremidades con el fin de evaluar la regeneración vascular, la angiogénesis y la arteriogénesis empleando diversas estrategias, como la administración de factor de crecimiento y el tratamiento celular. También puede usarse para evaluar los efectos proangiogénicos de las sustancias terapéuticas 3-12 y la recuperación natural en animales sanos 13, enfermos (diabéticos) 14-16 o de edad avanzada 17, y genéticamente intactos o genomanipulados por desactivación génica 18-20.
El sistema de obtención de imágenes de contraste de moteado láser PeriCam PSI se utiliza para confirmar la isquemia tras la intervención quirúrgica midiendo el descenso de la perfusión sanguínea en la microcirculación (60-70 %) y supervisando longitudinalmente la eficacia de la estrategia de tratamiento. Normalmente, cada animal se somete a seguimiento durante un periodo de hasta un mes tras la intervención quirúrgica/el tratamiento con PSI para registrar los incrementos progresivos en la perfusión sanguínea como resultado de la revascularización, ahorrando al investigador tiempo y dinero al reducir el número de animales necesario para el estudio.
Ensayo de membrana corioalantoidea (MCA) de pollo
La MCA se forma durante el desarrollo embrionario de los pollos por fusión de las capas mesodérmicas alantoidea y coriónica. Se trata de una membrana embrionaria no inervada y muy vascularizada, lo que la convierte en un sustrato ideal para el estudio de la angiogénesis y el crecimiento tumoral. Se incuba un huevo de gallina fertilizado entre cuatro y ocho días, momento en el que se crea una ventana en la cáscara que permite observar el embrión y los vasos sanguíneos que se están formando.
En el ensayo de angiogénesis se pueden administrar de forma tópica diversos fármacos y biomoléculas con el fin de estudiar su potencia angiogénica. También pueden implantarse andamiajes de material biocompatible, realizándose una supervisión de la invasión de los vasos a lo largo del tiempo para analizar una estrategia de ingeniería tisular.
En los modelos de cáncer, se pueden trasplantar distintos tipos de células cancerosas a la MCA para estudiar el crecimiento tumoral. De este modo, se obtiene un modelo relativamente sencillo para estudiar la formación de muchos tipos diferentes de tumores cancerosos y probar nuestros fármacos y estrategias de tratamiento personalizadas. El modelo de MCA es muy reproducible y rentable, y, a diferencia de muchos otros modelos con animales in vivo, no necesita de la aprobación de un comité de ética. Además, el modelo de MCA presenta una inmunodeficiencia natural, por lo que resulta ideal para el trasplante de células, y el sistema cerrado prolonga la semivida de muchas moléculas experimentales, lo cual reduce las cantidades necesarias para el estudio.
El sistema de obtención de imágenes de contraste de moteado láser PeriCam PSI puede usarse para medir el cambio en la perfusión sanguínea en el ensayo de angiogénesis y detectar diferencias en la eficacia de diversos componentes proangiogénicos. También puede usarse para supervisar la formación de vasos sanguíneos intratumorales funcionales 25 y evaluar la eficacia de los agentes antiangiogénicos en el tratamiento del cáncer.
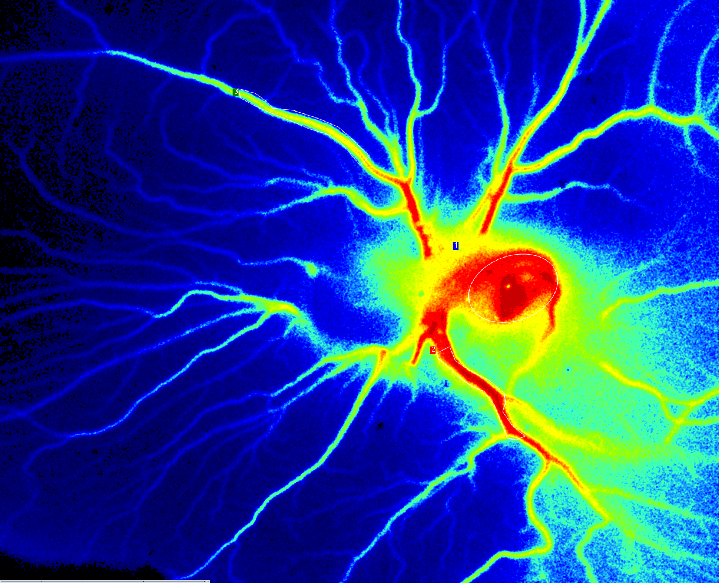
Perfusión con PSI Z en ensayo de la MCA el día 6 tras la fertilización.
Tumor Subcutáneo
El crecimiento y la metástasis de los tumores dependen del desarrollo de vasos sanguíneos y la eficacia de la microcirculación. Sin angiogénesis, un pequeño foco de células tumorales no puede crecer en una ubicación secundaria. La angiogénesis desempeña un papel fundamental en el crecimiento, la evolución, la invasión y la metástasis tumorales, por lo que su inhibición podría ser una estrategia para el tratamiento de algunos tipos de cáncer.
El modelo de tumor subcutáneo es el sistema de evaluación más popular para el análisis in vivo de nuevos candidatos a medicamentos antineoplásicos. Normalmente se emplean estirpes de animales inmunodeficientes, y las células cancerosas cultivadas se implantan a nivel subcutáneo, dando lugar a la formación de un tumor sólido en unas 2 semanas. Hay una gran variedad de estirpes de células cancerosas humanas y murinas adaptadas al crecimiento en huéspedes roedores, lo que permite la evaluación de las opciones terapéuticas en el modelo de tumor correspondiente. Los investigadores supervisan el crecimiento y la evolución de los tumores, y con frecuencia llevan a cabo un ensayo de densidad microvascular tumoral para comprobar la eficacia de la estrategia de tratamiento. PeriCam PSI puede utilizarse para supervisar la perfusión sanguínea en los tumores subcutáneos a lo largo del tiempo y evaluar la eficacia de los tratamientos antiangiogénicos para el tratamiento del cáncer.
Imágenes de perfusión en una oreja de ratón con tumor subcutáneo el día 14. Las imágenes muestran un aumento de la perfusión sanguínea tumoral como respuesta a un ataque térmico.
.
Bibliografía:
1. LED-Based Photoacoustic Imaging for Monitoring Angiogenesis in Fibrin Scaffolds. Yunhao Zhu, Xiaofang Lu, Xiaoxiao Dong, Jie Yuan, Mario L. Fabiilli, and Xueding Wang. 9, September 2019, Tissue Engineering Part C: Methods, Vol. 25, pp. 523-531.
2. Controlled release of basic fibroblast growth factor for angiogenesis using acoustically-responsive scaffolds. Alexander Moncion, Melissa Lin, Eric G. O’Neill, Renny T. Franceschi, Oliver D. Kripfgans, Andrew J. Putnam, Mario L. Fabiilli. 2017, Biomaterials, Vol. 140, pp. 26-36.
3. MiR-15b-5p Regulates Collateral Artery Formation by Targeting AKT3 (Protein Kinase B-3). Ling-Ping Zhu, Ji-Peng Zhou, Jia-Xiong Zhang, Jun-Yao Wang, Zhen-Yu Wang, Miao Pan, Ling-. May 2017, Arteriosclerosis, Thrombosis, and Vascular Biology, Vol. 37, pp. 957-968.
4. Precise and long-term tracking of adipose-derived stem cells and their regenerative capacity via superb bright and stable organic nanodots. Dan Ding, Duo Mao, Kai Li, Xiaomin Wang, Wei Qin, Rongrong Liu, David Shunzhong Chiam, Nikodem Tomczak, Zhimou Yang, Ben Zhong Tang, Deling Kong, Bin Liu. 12, 2014, ACS Nano, Vol. 8, pp. 12620-12631.
5. Extracellular Matrix Hydrogel Promotes Tissue Remodeling, Arteriogenesis, and Perfusion in a Rat Hindlimb Ischemia Model. Jessica L. Ungerleider, Todd D. Johnson, Melissa J. Hernandez, Dean I. Elhag, Rebecca L. Braden, Monika Dzieciatkowska, Kent G. Osborn, Kirk C. Hansen, Ehtisham Mahmud and Karen L. Christman. 1-2, 2016, JACC: Basic to Translational Science, Vol. 1, pp. 32-44.
6. Engineering an Injectable Muscle-Specific Microenvironment for Improved Cell Delivery Using a Nanofibrous Extracellular Matrix Hydrogel. Nikhil Rao, Gillie Agmon, Matthew T. Tierney, Jessica L. Ungerleider, Rebecca L. Braden, Alessandra Sacco, Karen L. Christman. 2017, ACS Nano, Vol. 11, pp. 3851-3859.
7. Marrow-isolated adult multilineage inducible cells embedded within a biologically-inspired construct promote recovery in a mouse model of peripheral vascular disease. Cristina Grau-Monge, Gaëtan J-R Delcroix, Andrea Bonnin-Marquez, Mike Valdes, Ead Lewis Mazen Awadallah, Daniel F Quevedo, Maxime R Armour, Ramon B Montero, Paul C Schiller, Fotios M Andreopoulos and Gianluca D’Ippolito. 1, 2017, Biomedical Materials, Vol. 12, p. 015024.
8. Natural compound bavachalcone promotes the differentiation of endothelial progenitor cells and neovascularization through the RORα-erythropoietin-AMPK axis. Shuang Ling, Rong-Zhen Ni, Yunyun Yuan, Yan-Qi Dang, Qian-Mei Zhou, Shuang Liang, Fujiang Guo, Wei Feng, Yuanyuan Chen, Katsumi Ikeda, Yukio Yamori, and Jin-Wen Xu. 49, 2017, Oncotarget, Vol. 8, pp. 86188-86205.
9. Topical tissue nano-transfection mediates non-viral stroma reprogramming and rescue. Daniel Gallego-Perez, Durba Pal, Subhadip Ghatak, VeysiMalkoc, Natalia Higuita-Castro, Surya Gnyawali, Lingqian Chang, Wei-Ching Liao, Junfeng Shi, Mithun Sinha, Kanhaiya Singh, Erin teen, Alec Sunyecz, Richard Stewart, JordanMoore, Thomas Ziebro, Robert. 2017, Nature Nanotechnology, Vol. 12, pp. 974-979.
10. In vivo efficacy of endothelial growth medium stimulated mesenchymal stem cells derived from patients with critical limb ischemia. Rida Al-Rifai, Philippe Nguyen, Nicole Bouland, Christine Terryn, Lukshe Kanagaratnam, Gaël Poitevin, Caroline François, Catherine Boisson-Vidal, Marie-Antoinette Sevestre & Claire Tournois. 17, 2019, Journal of Translational Medicine, Vol. 9, p. 261.
11. NFAT5 promotes arteriogenesis via MCP‐1‐dependent monocyte recruitment. Zhang, Xing‐Chi Lin Miao Pan Ling‐Ping Zhu Quan Sun Zheng‐Shi Zhou Chuan‐Chang Li Guo‐Gang. 2, 2020, Journal of Cellular and Molecular Medicine, Vol. 24.
12. MicroRNA-146a Regulates Perfusion Recovery in Response to Arterial Occlusion via Arteriogenesis. Heuslein Joshua L., McDonnell Stephanie P., Song Ji, Annex Brian H., Price Richard J. 2018, Frontiers in Bioengineering and Biotechnology, Vol. 6, p. 1.
13. Denervation in Femoral Artery-Ligated Hindlimbs Diminishes Ischemic Recovery Primarily via Impaired Arteriogenesis. Yinghuan Cen, Junfeng Liu, Yuansen Qin, Ruiming Liu, Huijin Wang, Yu Zhou, Shenming Wang, Zuojun Hu. 5, 2016, PLOS One, Vol. 11, p. e0154941.
14. Elevating CXCR7 Improves Angiogenic Function of EPCs via Akt/GSK-3β/Fyn-Mediated Nrf2 Activation in Diabetic Limb Ischemia. Xiaozhen Dai, Xiaoqing Yan, Jun Zeng, Jing Chen, Yuehui Wang, Jun Chen, Yan Li, Michelle T Barati, Kupper A Wintergerst, Kejian Pan, Matthew A Nystoriak, Daniel J Conklin, Gregg Rokosh, Paul N Epstein, Xiaokun Li, Yi Tan. 2017, Circulation Research, Vol. 120, pp. e7-e23.
15. Sitagliptin-mediated preservation of endothelial progenitor cell function via augmenting autophagy enhances ischaemic angiogenesis in diabetes. Dai, X., Zeng, J., Yan, X., Lin, Q., Wang, K., Chen, J., Shen, F., Gu, X., Wang, Y., Chen, J., Pan, K., Cai, L., Wintergerst, K. A. and Tan, Y. 1, 2018, Journal of Cellular and Molecular Medicine, Vol. 22, pp. 89-100.
16. Endothelial Overexpression of Metallothionein Prevents Diabetes-Induced Impairment in Ischemia Angiogenesis Through Preservation of HIF-1α/SDF-1/VEGF Signaling in Endothelial Progenitor Cells. Kai Wang, Xiaozhen Dai, Junhong He, Xiaoqing Yan, Chengkui Yang, Xia Fan, Shiyue Sun, Jing Chen, Jianxiang Xu, Zhongbin Deng, Jiawei Fan, Xiaohuan Yuan, Hairong Liu, Edward C. Carlson, Feixia Shen, Kupper A. Wintergerst, Daniel J. Conklin, Paul N. Epstein. 8, August 2020, Diabetes, Vol. 69, pp. 1779-1792.
17. DNA Methyltransferase 1–Dependent DNA Hypermethylation Constrains Arteriogenesis by Augmenting Shear Stress Set Point. Joshua L. Heuslein, Catherine M. Gorick, Ji Song, Richard J. Price. 12, 2017, Journal of the American Heart Association, Vol. 6.
18. Loss of Endothelial CXCR7 Impairs Vascular Homeostasis and Cardiac Remodeling After Myocardial Infarction. Huifeng Hao, PhD, et al. 2017, Circulation, Vol. 135, pp. 1253-1264.
19. Vascular growth responses to chronic arterial occlusion are unaffected by myeloid specific focal adhesion kinase (FAK) deletion. Joshua L. Heuslein, Kelsey P. Murrell, Ryan J. Leiphart, Ryan A. Llewellyn, Joshua K. Meisner & Richard J. Price. 2016, Scientific Reports, Vol. 6, p. 27029.
20. Despite Normal Arteriogenic and Angiogenic Responses, Hindlimb Perfusion Recovery and Necrotic and Fibro-Adipose Tissue Clearance Are Impaired in MMP9 Deficient Mice. Meisner JK, Annex BH, Price RJ. 6, 2015, Journal of Vascular Surgery, Vol. 61, pp. 1583–1594.
21. Cutaneous Epithelial to Mesenchymal Transition Activator ZEB1 Regulates Wound Angiogenesis and Closure in a Glycemic Status–Dependent Manner. Singh, Kanhaiya and Sinha, Mithun and Pal, Durba and Tabasum, Saba and Gnyawali, Surya C. and Khona, Dolly and Sarkar, Subendu and Mohanty, Sujit K. and Soto-Gonzalez, Fidel and Khanna, Savita and Roy, Sashwati and Sen, Chandan K. 11, 2019, Diabetes, Vol. 68, pp. 2175-2190.
22. Correction of MFG-E8 Resolves Inflammation and Promotes Cutaneous Wound Healing in Diabetes. A. Das, S. Ghatak, M. Sinha, S. Chaffee, Noha S. Ahmed, N. L. Parinandi, E. S. Wohleb, J. F. Sheridan, C. K. Sen, and S. Roy. 12, 2016, The Journal of Immunology, Vol. 196, pp. 5089-5100.
23. Circulating Exosomal miR-20b-5p Inhibition Restores Wnt9b Signaling and Reverses Diabetes-Associated Impaired Wound Healing. Yuan Xiong, Lang Chen, Chenchen Yan, Wu Zhou, Yori Endo, Jing Liu, Liangcong Hu,Yiqiang Hu, Bobin Mi and Guohui Liu. 3, 2020, Small, Vol. 16, p. 1904044.
24. Saliva Exosomes-Derived UBE2O Promotes Angiogenesis in Cutaneous Wounds by Targeting SMAD6. Bobin Mi, Lang Chen, Yuan Xiong, Chenchen Yan, Hang Xue, Adriana C. Panay, Jing Liu, Liangcong Hu, Yiqiang Hu, Yun Sun, Faqi Cao, Wu Zhou, Guohui Liu. 18, 2020, Journal of Nanobiotechnology, Vol. 6, p. 68.
25. Laser speckle contrast analysis (LASCA) technology for the semiquantitative measurement of angiogenesis in in-ovo-tumor-model. Eric Pion, Claudia Asam, Anna-Lena Feder, Oliver Felthaus, Paul I. Heidekrueger,Lukas Prantl, Silke Haerteis, Thiha Aung. 2020, Microvascular Research, Vol. 133, p. 104072.
Complete el formulario para obtener más información
Aviso legal: Es posible que los productos que aparecen en el sitio web de Perimed no cuenten con autorización para la venta en todos los mercados.